再生医療の臨床応用が進む中、研究開発の現場において「iPS細胞ストックの構築と管理」は、製品の品質と安全性を左右する極めて重要な工程です。特に、将来的な商用化を見据えた場合、研究段階から規制要件を見据えた厳格な体制を敷くことが求められます。
しかし、GCTP省令への適合や、均質な細胞の大量製造に向けたマスターセルバンク(MCB)およびワーキングセルバンク(WCB)の運用は、多くの専門知識とリソースを必要とする難題です。本記事では、再生医療分野の製造責任者の方々に向けて、規制当局の要件を満たすiPS細胞ストックの構築手法や、リスクを最小化する在庫管理の実践的なプロセスについて解説します。安全かつ効率的な製造基盤を確立するための、一助となれば幸いです。
臨床応用を前提としたiPS細胞ストック構築の結論はGCTP適合とMCB/WCB体制の確立
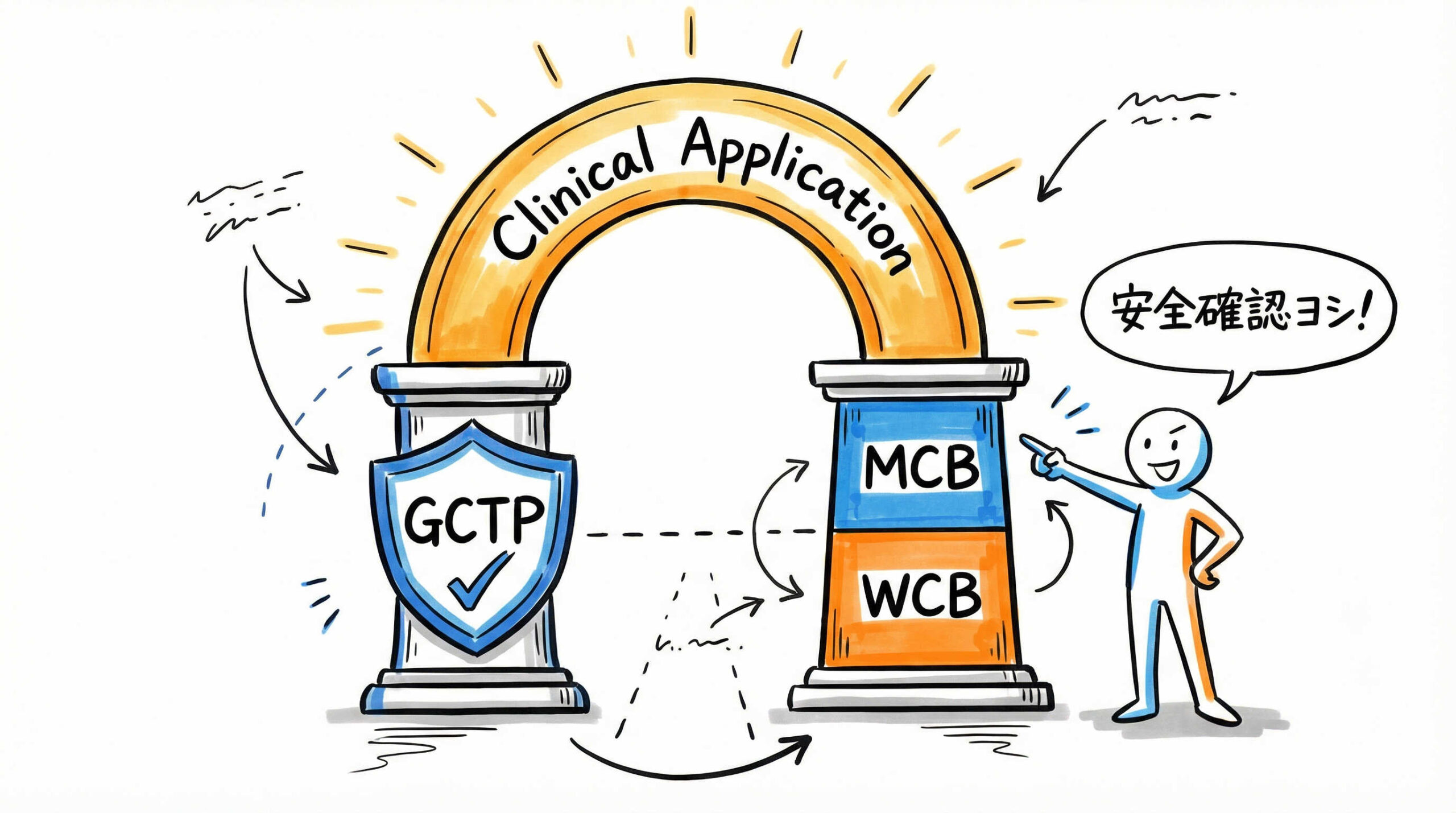
臨床応用を前提としたiPS細胞ストックの構築において、最も重視すべき結論は「GCTP省令への適合」と「MCB/WCBによる2層管理体制の確立」です。研究用細胞とは異なり、ヒトに投与する再生医療等製品では、原材料の受け入れから最終製品の出荷に至るまで、極めて高いレベルでの品質保証が求められます。ここでは、その根幹となる管理体制の要点について解説します。
再生医療等製品の製造管理・品質管理基準(GCTP省令)への完全適合
再生医療等製品の製造においては、「再生医療等製品の製造管理及び品質管理の基準に関する省令(GCTP省令)」への完全な適合が不可欠です。これは単に清潔な環境で細胞を培養すればよいということではありません。
ハードウェアとしての構造設備だけでなく、ソフトウェアとしての製造管理・品質管理システムが有機的に機能している必要があります。具体的には、品質保証部門(QA)の独立性確保、逸脱管理、変更管理、そして教育訓練などが厳格に運用されていることが求められるでしょう。これらの基準を満たすことで初めて、患者様への安全な製品供給が可能となります。
マスターセルバンク(MCB)とワーキングセルバンク(WCB)による2層管理
細胞製品の恒常性を保ち、長期にわたって安定供給を行うためには、マスターセルバンク(MCB)とワーキングセルバンク(WCB)による2層構造の管理システム(ティアードシステム)の導入が推奨されます。
まず、基点となるMCBを構築し、徹底的な特性解析を行います。そして、このMCBからWCBを調製し、日々の製造にはWCBを使用します。この体制により、貴重なMCBの枯渇を防ぎつつ、継代数(PDL)を一定範囲内に収めることが可能となります。結果として、製造ロットごとの品質のばらつきを抑え、長期的なプロジェクトにおいても均質な細胞を提供し続けることができるのです。
均質な細胞製品を安定供給するための製造プロセス検証
iPS細胞ストックの価値は、そこから製造される最終製品の品質がいかに安定しているかによって決まります。そのため、ストック構築の段階から、将来のスケールアップを見据えた製造プロセスの検証(プロセスバリデーション)を意識することが重要です。
培養条件、培地の組成、凍結・融解の手順など、あらゆるパラメータが細胞の品質に影響を与えます。したがって、単に細胞を増やすだけでなく、「定めた手順通りに製造すれば、常に規格に適合した細胞が得られる」ことを科学的に立証し、文書化しておく必要があります。このプロセス検証が不十分であれば、後の臨床試験段階で手戻りが発生するリスクが高まるでしょう。
再生医療の産業化において厳格な細胞ストック管理が不可欠な理由
なぜ、再生医療の産業化において、これほどまでに厳格な「iPS細胞ストックの構築と管理」が求められるのでしょうか。その背景には、生きた細胞を扱うがゆえの特有のリスクと、医薬品としての高い公共性があります。ここでは、科学的な品質リスクと規制対応の両面から、厳格な管理が不可欠である理由を掘り下げていきます。
長期培養に伴う遺伝子変異リスクと造腫瘍性の排除
iPS細胞は無限の増殖能を持つ一方で、長期培養に伴いゲノム不安定性が増大するリスクを孕んでいます。継代を重ねる中で生じる遺伝子変異は、細胞の特性を変化させるだけでなく、最悪の場合、造腫瘍性(がん化)につながる懸念があります。
適切なストック管理を行い、規定された継代数以内で製造を完了させることは、こうした変異リスクを制御するために極めて重要です。また、ストック構築時に詳細なゲノム解析を行い、あらかじめリスク因子を排除しておくことは、患者様の安全を守るための必須条件といえるでしょう。
製造ロット間での品質バラつき(Lot-to-Lot変異)の最小化
化学合成医薬品とは異なり、細胞製品は原材料である細胞そのものの性質が製造ロットごとの品質に大きく影響します。これを「Lot-to-Lot変異」と呼びますが、産業化においては、このばらつきを最小限に抑えることが求められます。
もしストック管理がずさんであれば、製造のたびに細胞の増殖速度や分化効率が異なり、規格外製品が多発することになりかねません。厳格に管理された単一のMCBを出発点とすることで、生物学的なばらつきの要因を固定し、製品品質の再現性を高めることが可能となります。これは製造コストの削減にも直結する重要な視点です。
規制当局への申請資料作成におけるデータの完全性(Data Integrity)確保
医薬品医療機器総合機構(PMDA)などの規制当局へ承認申請を行う際、提出するデータには完全性(Data Integrity)が求められます。これは、「データが正確で、完全で、信頼できるものである」という保証です。
細胞ストックの来歴、培養記録、試験結果などが、ALCOA+の原則(帰属性、判読性、同時性、原本性、正確性など)に従って記録・保管されていなければなりません。もし管理体制に不備があり、データの信頼性が損なわれれば、どれほど優れた治療効果を持つ細胞であっても、承認を得ることは困難でしょう。厳格な管理は、申請資料の信頼性を担保する基盤となります。
万が一の汚染や災害時に備えたバックアップ体制の必要性
細胞ストックは、企業の知的財産そのものであり、代替のきかない貴重な資産です。一つの施設のみで保管している場合、機器の故障、コンタミネーション(汚染)、あるいは地震や火災などの災害によって、すべてを失うリスクがあります。
したがって、物理的に離れた複数の拠点にストックを分散保管するバックアップ体制の構築は、事業継続計画(BCP)の観点からも不可欠です。厳格な管理体制には、こうした不測の事態を想定したリスクマネジメントも含まれているべきです。
規制要件を満たすiPS細胞ストック構築の具体的な実務プロセス
概念的な重要性を理解した上で、次は実務的な側面に目を向けてみましょう。規制要件を満たすiPS細胞ストックを構築するためには、原材料の選定から製造記録の管理に至るまで、細部にわたる注意が必要です。ここでは、現場の責任者が押さえておくべき具体的な実務プロセスについて詳述します。
ドナー適格性確認と原材料(培地・試薬)の生物由来原料基準適合性
iPS細胞の樹立にあたっては、まずドナーの適格性確認が必要です。既往歴や感染症の有無に関する問診、およびウイルス検査を行い、安全性を確認します。また、インフォームド・コンセント(同意取得)も倫理指針に則り適切に行われなければなりません。
さらに、培養に使用する培地や試薬については、「生物由来原料基準」への適合性を確認する必要があります。特にウシ胎児血清(FBS)などの動物由来成分を使用する場合は、原産国の安全性やウイルス不活化処理の証明書を入手し、リスクを管理することが求められます。可能な限り、動物由来成分を含まない(Xeno-free)材料を選択することが望ましいでしょう。
クローン選抜における未分化維持能力と分化能の評価基準
樹立された多数のiPS細胞クローンの中から、MCB候補となる最適な株を選抜するプロセスは極めて重要です。評価基準としては、未分化マーカーの発現維持や、正常な核型といった基本的な性質に加え、目的とする細胞への分化能が鍵となります。
また、増殖速度や凍結融解後の生存率も、将来の製造効率を左右する要素です。これらの指標を総合的に評価し、最も安定して高品質な製品を製造できるクローンを選定します。選抜の過程と根拠を詳細に記録しておくことは、後のレギュレーション対応においても強力なエビデンスとなります。
ウイルス否定試験およびマイコプラズマ否定試験の実施タイミング
細胞ストックの安全性を担保するためには、適切なタイミングでのウイルス否定試験およびマイコプラズマ否定試験の実施が必須です。一般的には、MCBおよびWCBの製造完了時に実施します。
特にウイルス試験については、外来性ウイルスの混入がないことを確認するため、in vitro試験やPCR法など、感度と特異性の高い手法を組み合わせて行います。また、マイコプラズマ汚染は細胞の性質を変化させる可能性があるため、培養工程の節目で定期的にモニタリングすることも推奨されます。これらの試験結果は、製品の出荷判定(Batch Release)における最重要項目の一つです。
核型解析と全ゲノムシーケンスによる遺伝学的安定性の確認
iPS細胞の遺伝学的安定性を確認するために、従来のG-band分染法による核型解析に加え、近年ではより高解像度な解析手法が求められるようになっています。
例えば、マイクロアレイを用いたコピー数多型(CNV)解析や、次世代シーケンサー(NGS)による全ゲノムシーケンス、エクソームシーケンスなどが挙げられます。これらにより、がん関連遺伝子の変異や微細な欠失・重複を検出することが可能です。どこまでの解析が必要かは、対象疾患や投与経路のリスクに応じて規制当局との相談が必要になる場合もありますが、科学的な安全性の説明責任を果たすためのデータ取得は不可避です。
製造指図記録書およびSOP(標準作業手順書)の整備と運用
どれほど優れた設備があっても、作業の手順が標準化されていなければ品質は安定しません。GCTP省令に基づき、製造指図記録書および標準作業手順書(SOP)を整備し、それに基づいて業務を遂行することが求められます。
SOPには、細胞の解凍、培養、継代、凍結といった操作手順だけでなく、機器の点検、清掃、異常時の対応なども網羅します。そして、実際の作業においては、誰が、いつ、何を行ったかを製造指図記録書に逐一記載し、ダブルチェックを行うことでヒューマンエラーを防止します。文書管理システムの導入により、版数管理や承認フローを電子化することも効率的です。
iPS細胞ストックの品質を維持するための保管・在庫管理手法
構築されたiPS細胞ストックは、使用されるその時まで、品質を損なうことなく保管され続けなければなりません。適切な保管環境と在庫管理システムは、細胞のバイアビリティ(生存率)とトレーサビリティを保証する要です。ここでは、品質維持のための具体的な保管・管理手法について解説します。
液体窒素気相保存における温度逸脱防止とモニタリングシステム
細胞ストックの長期保存には、極低温環境が必須です。一般的には液体窒素タンクが用いられますが、コンタミネーションのリスクを低減するため、液体窒素に直接浸漬する液相保存ではなく、気相保存(-150℃以下)が推奨されます。
気相保存では、タンク内の温度勾配に注意が必要です。常時モニタリングシステムを導入し、温度逸脱や液体窒素のレベル低下が発生した際に、即座に警報が発報される仕組みを構築しましょう。また、停電時のバックアップ電源や、液体窒素の自動供給システムも、安定保管には欠かせない設備です。
凍結融解後の生存率を担保するプログラムフリーザーの活用
細胞の凍結保存において、最もダメージを受けやすいのが凍結のプロセスです。急激な温度低下は細胞内での氷晶形成を招き、細胞膜やオルガネラを損傷させる原因となります。
これを防ぐために、プログラムフリーザー(プログラムディープフリーザー)の活用が効果的です。毎分-1℃といった最適な冷却速度を正確にコントロールすることで、細胞へのストレスを最小限に抑えることができます。特にiPS細胞は凍結融解のストレスに敏感であるため、生存率を高く維持するためには、緩慢凍結法の厳密な適用が求められます。
バーコード管理システム導入による検体取り違え防止とトレーサビリティ確保
膨大な数のチューブを管理する中で、検体の取り違えは絶対に避けなければならない重大なミスです。手書きのラベル管理には限界があるため、バーコードや2次元コードを用いた在庫管理システムの導入が強く推奨されます。
入出庫の際にバーコードをスキャンすることで、どの細胞が、いつ、誰によって、どのタンクのどの位置に保管されたかを正確に記録できます。これにより、トレーサビリティ(追跡可能性)が確保されるだけでなく、棚卸し業務の効率化や、特定のロットの迅速な検索も可能となります。システム上で在庫状況を可視化することは、管理ミスを防ぐ有効な手段です。
定期的な一部解凍による性状確認試験(安定性試験)の実施
保管中の細胞が、経年変化によって品質劣化していないかを確認することも重要です。これを安定性試験と呼びます。定期的に(例えば1年ごと、3年ごとなど)ストックの一部を解凍し、性状確認試験を実施します。
生存率、増殖能、未分化マーカーの発現、核型などを評価し、保管開始時のデータと比較します。これにより、保管環境の妥当性を検証するとともに、有効期限の設定根拠となるデータを蓄積することができます。長期にわたるプロジェクトでは、この安定性データが品質保証の信頼性を支える柱となります。
自社構築と外部委託(CDMO)の比較と最適な運用フローの選択
iPS細胞ストックの構築と管理には、多大なコストと専門性が要求されます。そのため、すべてを自社で完結させるのか、あるいは外部のリソースを活用するのかは、経営戦略上の重要な判断となります。最後に、自社構築と外部委託(CDMO)の比較を行い、事業フェーズに応じた最適な運用フローの選択について考察します。
自社でCPC(細胞加工施設)を保有・維持する場合のコストとリソース
自社でCPC(細胞加工施設)を保有し、GCTP適合レベルで維持管理を行うには、莫大な初期投資とランニングコストがかかります。空調設備の維持、環境モニタリング、清浄度の維持に加え、高度なスキルを持つ製造スタッフや品質管理担当者の雇用・育成も必要です。
自社保有のメリットは、ノウハウの蓄積やスケジュールの柔軟性、迅速なトラブルシューティングが可能になる点です。しかし、臨床開発の初期段階など、製造頻度が低い時期においては、固定費が経営を圧迫するリスクも考慮しなければなりません。
公的機関や商用バンクからのiPS細胞ストック導入のメリット・デメリット
京都大学iPS細胞研究財団(CiRA_Foundation)などの公的機関や、商用バンクからiPS細胞ストックを導入する方法もあります。これらの細胞は既に品質評価がなされており、ドナーの同意取得や感染症検査もクリアしているため、開発期間を大幅に短縮できる点が最大のメリットです。
一方で、利用目的や商用化におけるライセンス料、第三者への譲渡制限などの制約が存在する場合があります。また、自社の目的とする分化誘導に適した株であるとは限らないため、事前の適合性評価は欠かせません。スピードを重視する場合の有効な選択肢と言えるでしょう。
CDMO(医薬品受託製造開発機関)活用による製造コスト削減とリスク分散
CDMO(医薬品受託製造開発機関)への委託は、自社リソースを研究開発や臨床試験の推進に集中させるための合理的な戦略です。CDMOはGMP/GCTP準拠の設備と豊富な経験を持っており、MCB/WCBの構築から保管管理までをワンストップで任せることができます。
製造コストを変動費化できるため、財務リスクの分散にもつながります。ただし、委託先の選定にあたっては、品質管理体制の監査や、技術移転のスムーズさ、コミュニケーションの質を慎重に見極める必要があります。パートナーとしての信頼関係構築が成功の鍵です。
開発フェーズ(基礎研究・非臨床・臨床)に応じた管理体制の移行戦略
最適な管理体制は、開発フェーズによって変化します。基礎研究段階では、柔軟性を重視した小規模な管理で十分かもしれません。しかし、非臨床試験(GLP)から臨床試験(GMP/GCTP)へと進むにつれ、管理レベルを段階的に引き上げる必要があります。
例えば、非臨床段階でMCBを確立し、臨床試験開始に合わせてCDMOへ技術移転を行う、あるいは初期臨床は自社CPCで行い、商用生産に向けてCDMOへ移行するなど、ロードマップを描いておくことが重要です。将来の規制要件を見越した「先読み」の戦略が、スムーズな事業展開を可能にします。
まとめ
iPS細胞ストックの構築と管理は、再生医療製品の品質、安全性、そして事業の成否を分ける基盤です。臨床応用を目指すならば、GCTP省令への適合を前提とし、MCB/WCBによる2層管理体制を早期に確立することが求められます。
厳格なドナー適格性確認、製造プロセスの検証、そしてデータインテグリティの確保は、規制当局の承認を得るための必須条件です。また、液体窒素を用いた適切な保管管理やトレーサビリティの確保も、長期的な品質維持には欠かせません。
自社で全てを賄うのか、CDMO等の外部リソースを活用するのかは、コストとスピードのバランスを考慮した戦略的な判断が必要です。確実なストック管理体制を構築し、安全な再生医療を患者様に届けるための第一歩を踏み出しましょう。
iPS細胞ストックの構築と管理についてよくある質問

以下に、iPS細胞ストックの構築と管理に関して、現場の責任者から寄せられることの多い質問をまとめました。実務における疑問の解消にお役立てください。
-
iPS細胞のMCB(マスターセルバンク)は何本くらい製造すべきですか?
- 将来の製造計画やWCB(ワーキングセルバンク)のサイズにもよりますが、一般的には100〜200本程度を確保することが推奨されます。これにより、WCBを継続的に更新しても、数十年単位で元となるMCBを維持することが可能になります。また、安定性試験やバックアップ保管用の本数も考慮に入れて計画する必要があります。
-
研究用iPS細胞をそのまま臨床用に転用することは可能ですか?
- 原則として非常に困難です。臨床用に使用するためには、ドナーの同意内容(インフォームド・コンセント)が臨床利用をカバーしているか、原材料が生物由来原料基準を満たしているか、樹立履歴が正確に記録されているか等が問われます。これらを遡って証明できない場合、新たに臨床用として樹立し直す(リプログラミング)方が、結果として近道になることが多いでしょう。
-
WCB(ワーキングセルバンク)の更新タイミングはいつですか?
- WCBの在庫が少なくなった時や、あらかじめ定めた有効期限が近づいた時が更新のタイミングです。ただし、WCBが枯渇してから慌てて製造するのではなく、品質試験や承認プロセスにかかる時間を考慮し、余裕を持って次期WCBの製造計画を立てることが重要です。また、更新時にはMCBから新たに起こすことが基本となります。
-
海外規制(FDAやEMA)にも対応したストック構築の注意点は?
- 各国の規制当局によって、ドナーのスクリーニング項目や原材料の基準が異なる場合があります。例えば、特定の地域への渡航歴によるドナー除外基準などが異なります。グローバル展開を視野に入れている場合は、最も厳しい基準(例えば日米欧三極の要件)を網羅したプロトコルでストックを構築しておくことが、後の障壁を下げる鍵となります。
-
外部保管サービスを利用する際の選定ポイントは?
- GCTP/GMPに準拠した管理体制であることは大前提です。その上で、24時間365日の温度監視システム、非常用電源の冗長性、セキュリティ体制、そして検体の入出庫スピードや緊急時の対応フローを確認しましょう。また、定期的な監査を受け入れているかどうかも、信頼性を判断する重要な指標となります。